Premisa
El Carbonato de Calcio (CaCO3) es uno de los carbonatos más abundantes en las rocas sedimentarias de toda la superficie terrestre. CaCO3 se presenta en la naturaleza en 6 formas diferentes: tres polimorfos cristalinos anhidros.
Calcita, Aragonita y Vaterita, dos fases hidratadas y algunas formas amorfas hidratadas o anhidras. Las tres formas de cristales polimórficos muestran estructuras bien diferenciadas
- Calcita (red trigonal)
- Aragonito (red ortorrómbica)
- Vaterita (patrón hexagonal)
como tal, las tres fases tienen diferentes espectros de difracción y, por lo tanto, son fácilmente identificables con métodos de investigación específicos.
Metodología de análisis
La identificación de las diferentes fases del carbonato de calcio en agua sanitaria se realizó tanto por análisis de difracción de rayos X (difractómetro) como por espectroscopia infrarroja (FT-IR).
Ambos análisis se realizaron sobre el residuo fijado obtenido con un procedimiento específico para no invalidar el propio análisis. Los espectros que identifican las diversas formas y cristalinos de CaCO3 responden con diferentes ángulos de difracción y por lo tanto dan diagramas claramente identificables (como si cada fase tuviera su propia huella).
Los resultados obtenidos de las diferentes muestras se compararon con los espectros de las fases puras: Calcita – Aragonito – Vaterita.
Esta comparación se realizó para agua sin tratar y para agua tratada con el dispositivo ExtraH2O Los análisis se realizaron en diferentes condiciones: temperatura del acueducto a tiempo cero; temperatura 60°C después de 36h; temperatura 80°C a tiempo cero.
Conclusiones
En todas las muestras analizadas, el tratamiento del agua con ExtraH2O ciertamente aumenta el contenido de formas amorfas y la presencia de posibles formas hidratadas (resaltadas en particular por los análisis infrarrojos).
En estas condiciones se produce un aumento de la solubilidad del carbonato de calcio en agua con una disminución relativa de la formación de cristales y acumulaciones de residuo fijo.
La desaparición de la Calcita y la formación de Aragonito es evidente a temperaturas en torno a los 60°C. Tal y como se describe en la literatura científica, en el análisis realizado tras 36h a 60°C el Aragonito debería haberse transformado en calcita (polimorfo más estable) pero esta transformación no se produjo gracias al tratamiento del agua con ExtraH2O.
Alcanzando una temperatura de 80°C y analizando el agua en tiempo cero, el sistema evita la formación de cristales estables de Calcita, dejando solo formas amorfas hidratadas de los diversos cristales, evitando precipitaciones y acumulaciones rápidas de concreciones calcáreas. Según la literatura, el agua tenderá a reformar la calcita después de un cierto período de tiempo. A estas temperaturas, por lo tanto, el efecto de ExtraH2O es temporal.
La innovadora tecnología de PEFs para la inactivación microbiana de alimentos
El presente trabajo se refiere a la aplicación de un sistema innovador para la inactivación microbiana, mediante campos eléctricos pulsados (PEF).
El uso de PEF, documentado por análisis de experiencias previas y por la literatura del sector, sugiere que la técnica es efectiva para descomponer la población bacteriana de los alimentos líquidos.
Resultados
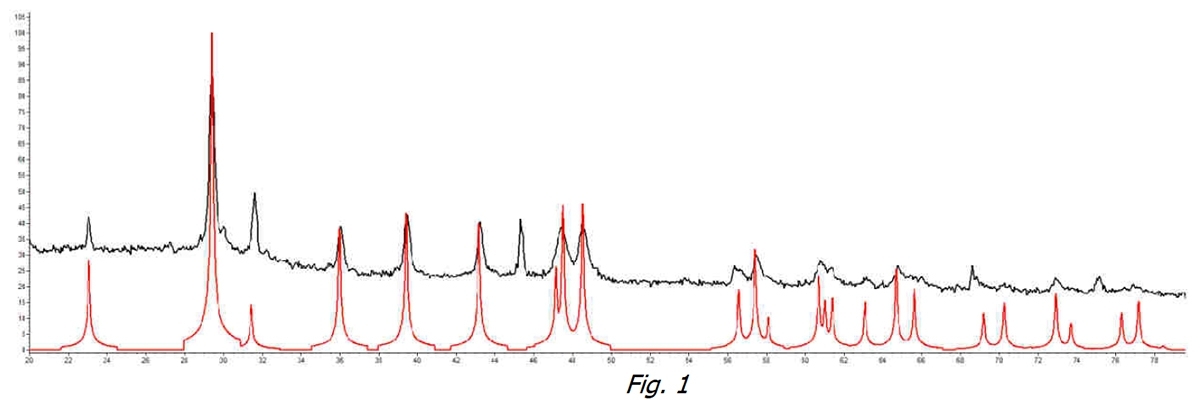
Comenzamos analizando el agua sin tratar. En la Figura 1 podemos ver cómo y en la muestra de agua sin tratar a la temperatura del acueducto (línea negra) hay un pico identificador de Calcita (para comparación con la línea roja, refiérase a Calcita pura) que identifica esta forma cristalina como la predominante.
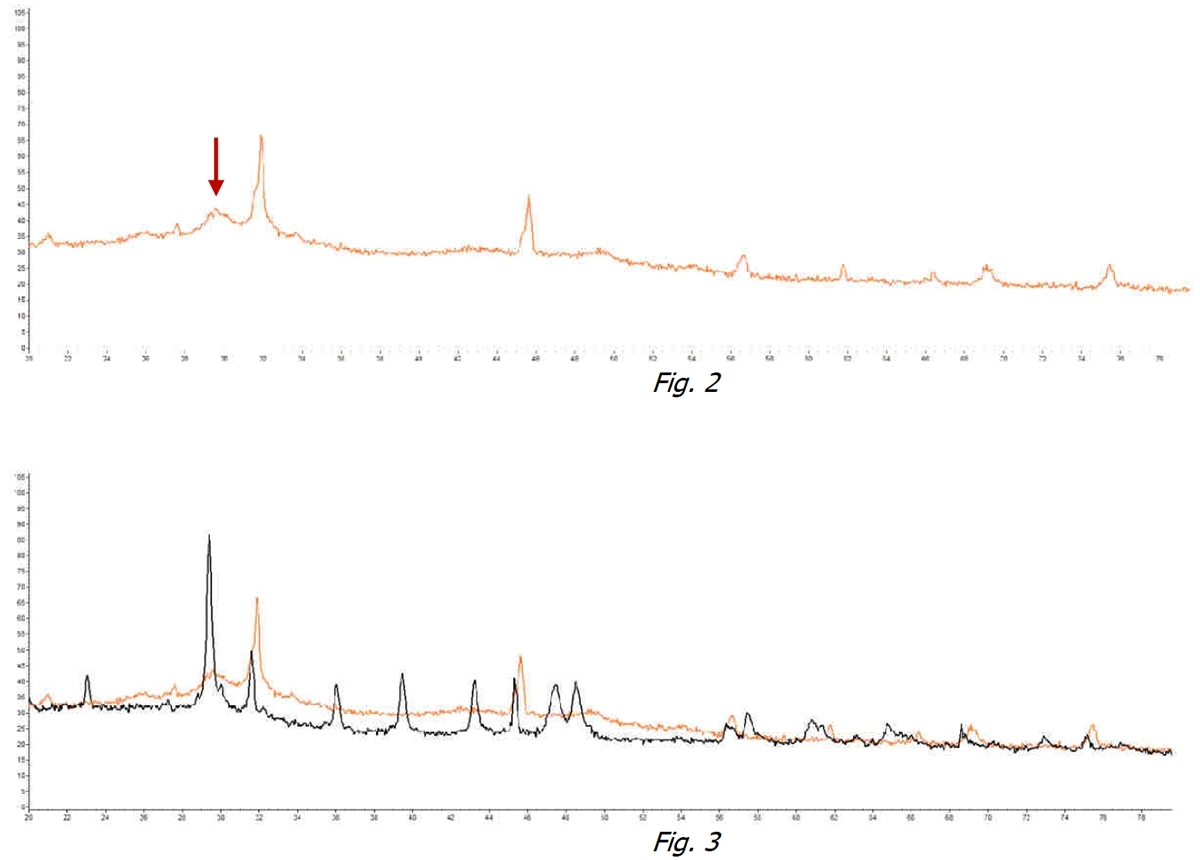
En la Figura 2 se puede observar como en la misma agua sometida a tratamiento con el dispositivo ExtraH2O el pico identificador de Calcita desaparece en favor de una «joroba» sin pico específico. En general desaparecen todos los picos identificativos de una cristalización. Esto atestigua que no se han formado cristales de Calcita sino que por el contrario hay una forma amorfa idrata no cristalizada.
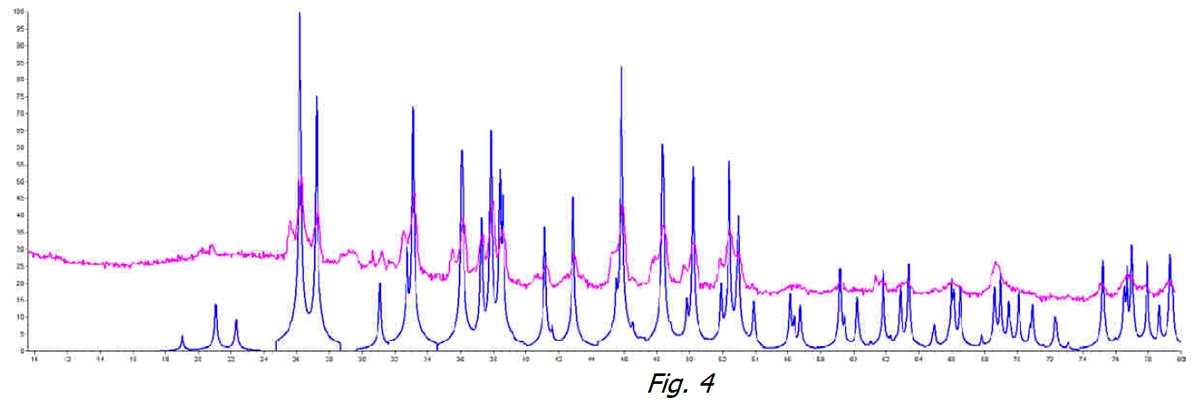
Si luego comparamos las dos muestras de agua tratada (línea naranja) y no tratada (línea negra) en la Figura 3, el fenómeno de la no cristalización es claramente visible. El CaCO3 no tiene forma de agregarse en ninguna de sus formas cristalinas estables.
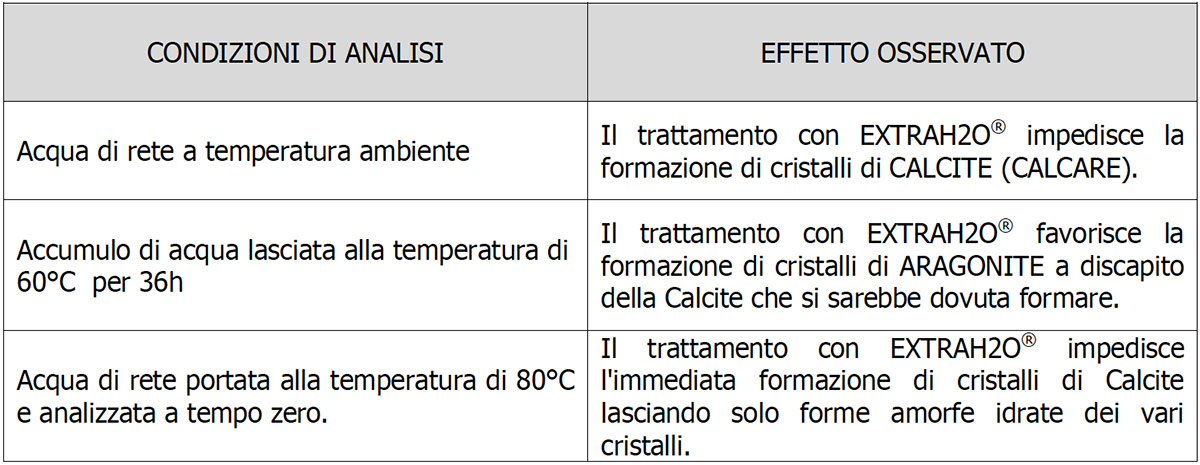
La muestra de agua tratada con ExtraH2O dejada durante 36 ha una temperatura de 60°C (Fig.4) muestra la clara presencia de Aragonito en forma cristalina. El espectro del ejemplar (línea fucsia) es perfectamente superponible al del Aragonito puro (línea azul). Como también se reporta en la literatura a 60°C la fase más estable de CaCO3 es la Aragonita en ausencia total de Calcita cristalina.
En la Figura 5 podemos comparar la muestra sin tratar a temperatura ambiente (línea negra) y la tratada llevada a 80°C (línea morada). Del gráfico es evidente que todos los picos se han reducido, lo que demuestra que no se pueden formar cristales estables de Calcita.