Premessa
Il Calcio Carbonato (CaCO3) è uno o dei carbonati più abbondanti nelle rocce sedimentarie di tutta la superficie terrestre. Il CaCO3 si presesenta in natura in 6 differenti forme: tre polimorfi cristallini anidri.
Calcite, Aragonite e Vaterite, due fasi idrate e alcune forme amorfe anidre o idrate. Le tre forme polimorfe di cristallo mostrano strutture ben differenziate
- Calcite (reticolo trigonale)
- Aragonite (reticolo ortorombico)
- Vaterite (reticolo esagonale)
come tali le tre fasi hanno spettri di diffrazione differenti e sono quindi ben identificabili con specifici metodi di indagine.
Metodologia di analisi
L’identificazione delle diverse fasi del Carbonato di Calcio nell’acqua sanitaria è stata effettuata sia mediante analisi a diffrazione Raggi X (diffrattometro) sia con Spettroscopia Infrarossa (FT-IR).
Entrambe le analisi sono state condotte sul residuo fisso ottenuto con una specifica procedura in modo da non inficiare l’analisi stessa. Gli spettri che identificano le varie forme e cristalline del CaCO3 rispondono con angoli di diffrazione differenti e quindi danno diagrammi ben identificabili (come se ogni fase avesse la propria impronta).
I risultati ottenuti dai diversi campioni sono stati confrontati con gli spettri delle fasi pure: Calcite – Aragonite – Vaterite.
Questo confronto è stato fatto per l’acqua non trattata e per l’acqua trattata con il dispositivo ExtraH2O Le analisi sono state effettuate in diverse ccondizioni: temperatura acquedotto a tempo zero; temperatura 60°C dopo 36h; temperatura 80°C a tempo zero.
Conclusioni
In tutti i campioni analizzati il trattamento dell’acqua con ExtraH2O aumenta sicuramente il contenuto di forme amorfe e la presenza di possibili forme idrate (evidenziate in particolare dalle analisi con infrarossi).
In queste condizioni si ha un aumento di solubilità del carbonato di calcio in acqua con relativa diminuzione di formazione di cristalli e accumuli di residuo fisso.
La scomparsa di Calcite e la formazione di Aragonite è netta alle temperature intorno ai 60°C. Come descritto in letteratura scientifica, nella analisi condotta dopo 36h a 60°C l’Aragonite si sarebbe dovuta trasformare in calcite (polimorfo più stabile) ma questa trasformazione non si è verificata grazie al trattamento dell’acqua con ExtraH2O.
Arrivando fino alla temperatura di 80°C ed analizzando l’acqua a tempo zero il sistema impedisce la formazione di cristalli di Calcite stabili lasciando solo forme amorfe idrate dei vari cristalli evitando la precipitazione e accumuli di concrezioni calcaree veloci. Secondo la letteratura l’acqua tenderà dopo un certo periodo di tempo a riformare calcite. A queste temperature quindi l’effetto di ExtraH2O è temporaneo.
La tecnologia innovativa dei PEF per l’inattivazione microbica degli alimenti
Il presente lavoro riguarda l’applicazione di un sistema innovativo per l’inattivazione microbica, mediante campi elettrici pulsati (PEF).
L’impiego dei PEF, documentata dalle analisi delle esperienze pregresse e dalla letteratura del settore suggeriscono che la tecnica sia efficace per abbattere la popolazione batterica di alimenti liquidi.
Risultati
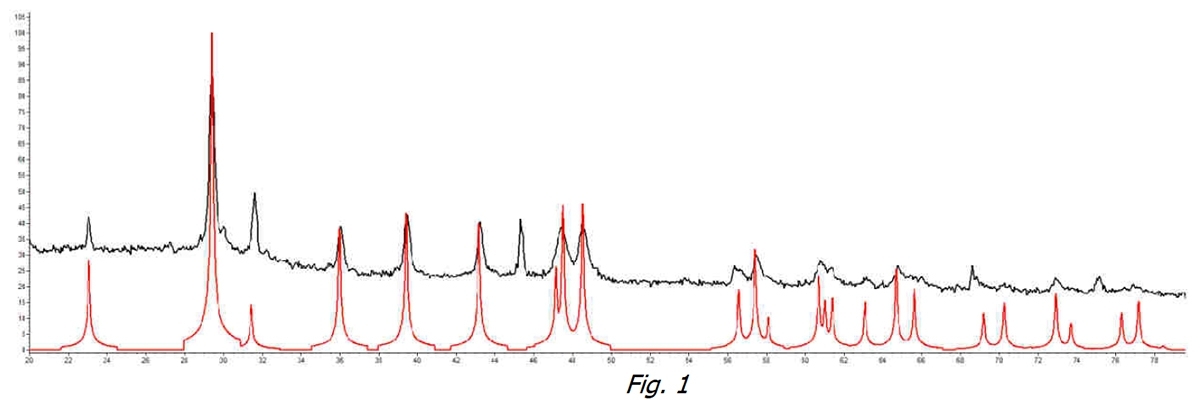
Si è partiti analizzando l’acqua non trattata. In Figura 1 possiamo vedere come e nel campione acqua a temperatura acquedotto non trattata (linea nera) vi sia un picco identificativo della Calcite (per confronto con la linea rossa, riferimento Calcite pura) che identifica questa forma cristallina come la prevalente.
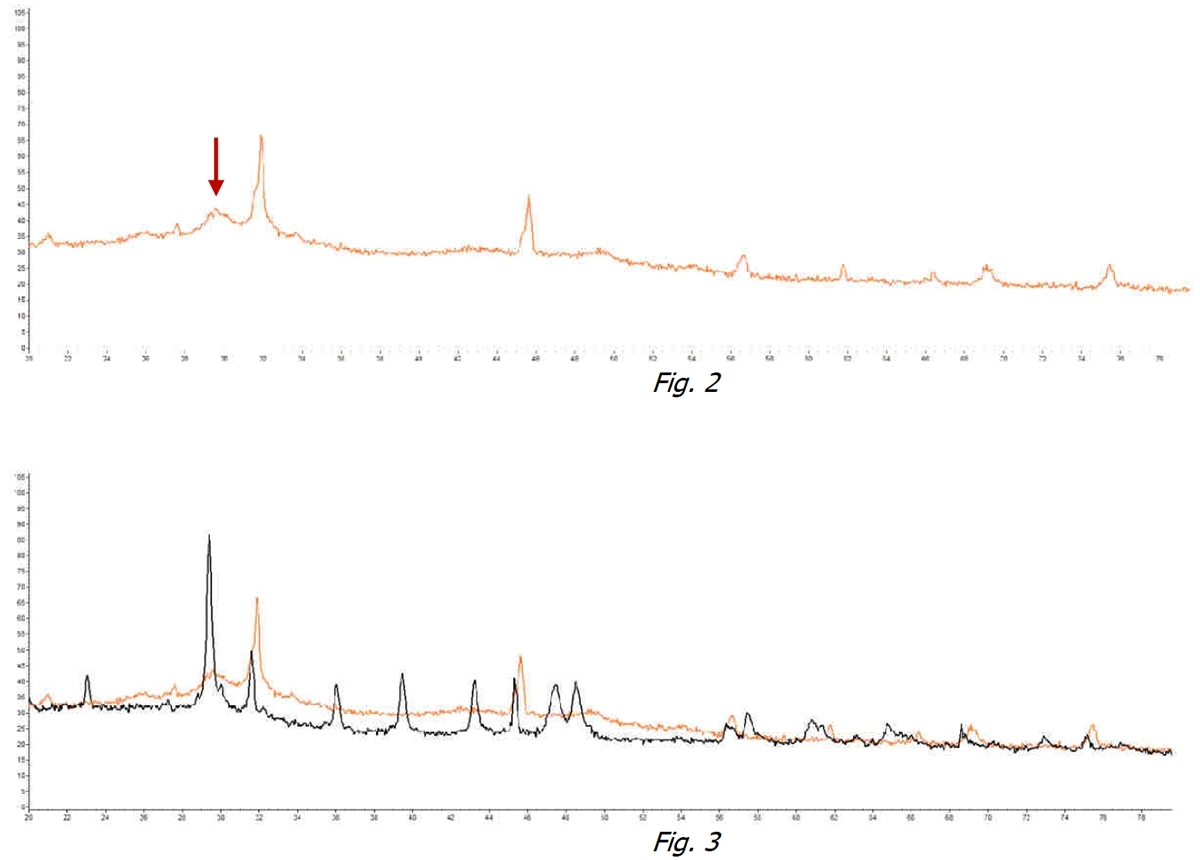
In Figura 2 si può notare come nella stessa acqua sottoposta al trattamento con il dispositivo ExtraH2O il picco identificativo della Calcite scompaia a favore di una “gobba” priva di uno specifico picco. In generale tutti i picchi identificativi di una cristallizzazione scompaiono. Questo testimonia che i cristalli di Calcite non si sono formati ma al contrario esiste una forma amorfa idrata non cristallizzata.
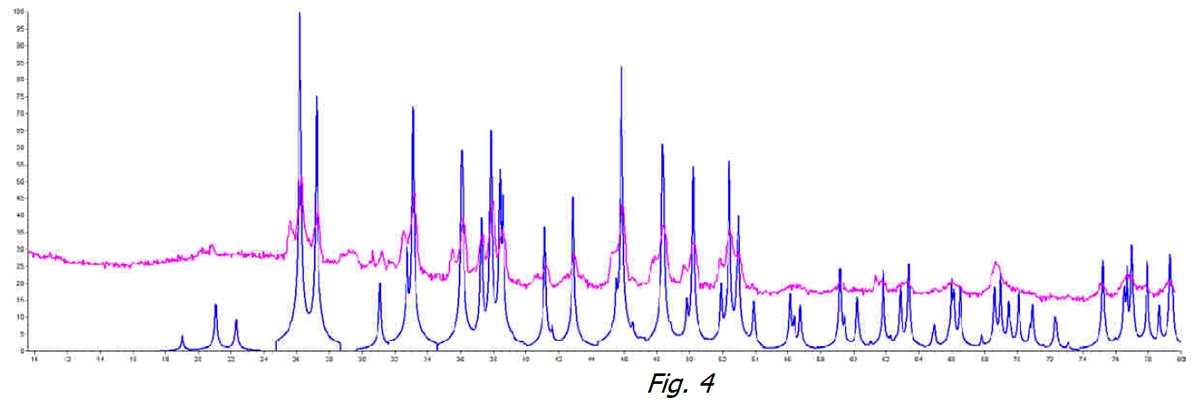
Se confrontiamo poi in Figura 3 i due campioni acqua trattata (linea arancio) e non trattata (linea nera) il fenomeno di non cristallizzazione è decisamente visibile. Il CaCO3 non ha modo di aggregarsi in nessuna delle sue forme cristalline stabili.
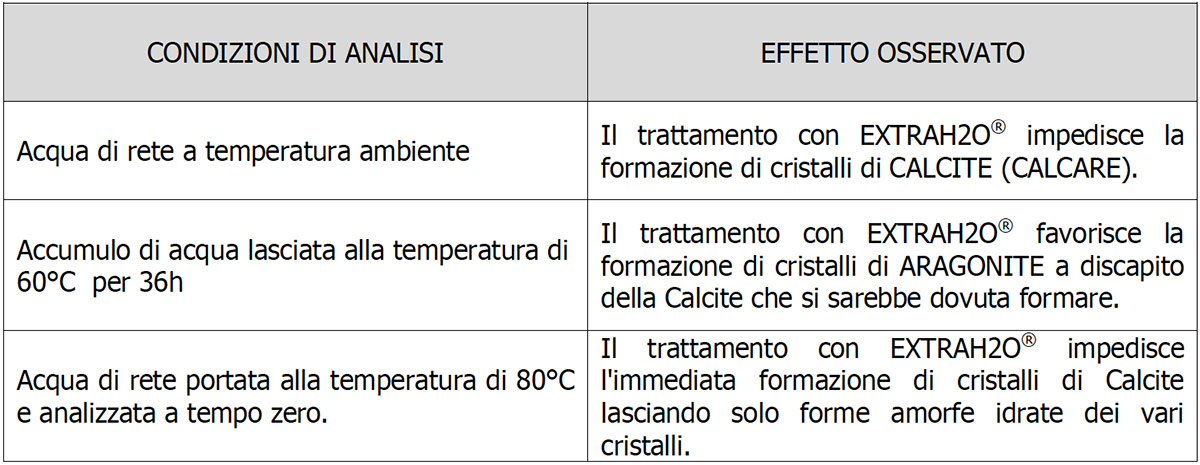
Il campione di acqua trattata con ExtraH2O lasciato per 36 h a temperatura di 60°C (Fig.4) mostra la netta presenza di Aragonite in forma cristallina. Lo spettro del campione (linea fucsia) è perfettamente sovrapponibile a quello della Aragonite pura (linea blu). Come viene riportato anche in letteratura a 60°C la fase più stabile del CaCO3 è l’Aragonite in totale assenza di Calcite cristallina.
Nella Figura 5 si può confrontare il campione non trattato a temperatura ambiente (linea nera) e quello trattato portato a 80°C (linea viola). Dal grafico è evidente come tutti i picchi si siano ridotti a testimonianza del fatto che non si riescono a formare cristalli di Calcite stabili.