Prémisse
Le carbonate de calcium (CaCO3) est l’un des carbonates les plus abondants dans les roches sédimentaires de toute la surface de la terre. Le CaCO3 est présent dans la nature sous 6 formes différentes: trois polymorphes cristallin anhydre.
Calcite, Aragonite et Vatérite, deux phases hydratées et certaines formes amorphe anhydre ou hydraté. Les trois formes cristallines polymorphes présentent des structures bien différenciées
- Calcite (réseau trigonal)
- Aragonite (réseau orthorhombique)
- Vathérite (réseau hexagonal)
en tant que telles, les trois phases ont des spectres de diffraction différents et sont donc facilement identifiables avec des méthodes d’investigation spécifiques.
Méthodologie d’analyse
L’identification des différentes phases du carbonate de calcium dans l’eau sanitaire a été réalisée à la fois par analyse par diffraction des rayons X (diffractomètre) et par spectroscopie infrarouge (FT-IR).
Les deux analyses ont été effectuées sur le résidu fixé obtenu avec une procédure spécifique afin de ne pas invalider l’analyse elle-même Les spectres qui identifient les différentes formes et cristallins de CaCO3 répondent par des angles de diffraction différents et donnent donc des diagrammes clairement identifiables (comme si chaque phase avait sa propre empreinte).
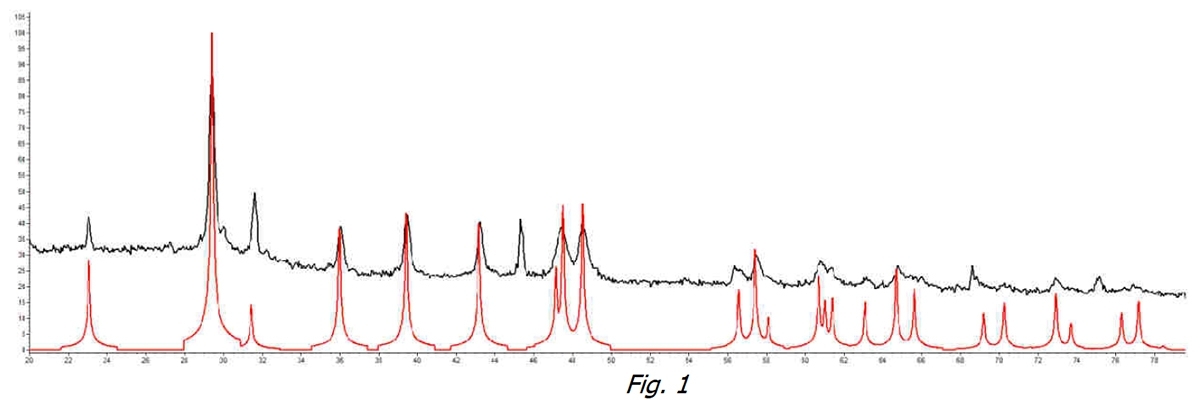
Les résultats obtenus sur les différents échantillons ont été comparés aux spectres des phases pures: Calcite – Aragonite – Vathérite.
Cette comparaison a été faite pour l’eau brute et l’eau traitée avec l’appareil ExtraH2O Les analyses ont été réalisées dans différentes conditions: température de l’aqueduc au temps zéro; température 60°C après 36h; température 80°C au temps zéro.
Conclusion
Dans tous les échantillons analysés, le traitement de l’eau avec ExtraH2O augmente certainement la teneur en formes amorphes et la présence d’éventuelles formes hydratées (mis en évidence notamment par les analyses infrarouges).
Dans ces conditions on observe une augmentation de la solubilité du carbonate de calcium dans l’eau avec une diminution relative de la formation de cristaux et des accumulations de résidu fixe.
La disparition de la calcite et la formation de Aragonite il est clair à des températures autour de 60°C. Comme décrit dans la littérature scientifique, dans l’analyse menée après 36h à 60°C l’Aragonite aurait dû se transformer en calcite (polymorphe plus stable) mais cette transformation ne s’est pas produite grâce au traitement de l’eau avec ExtraH2O.
En atteignant une température de 80°C et en analysant l’eau en un temps zéro, le système empêche la formation de cristaux stables de calcite, ne laissant que des formes amorphes hydratées des différents cristaux, évitant les précipitations et les accumulations rapides de concrétions calcaires. Selon la littérature, l’eau aura tendance à reformer de la calcite après un certain temps. À ces températures, l’effet de ExtraH2O est donc temporaire.
La technologie innovante des PEF pour l’inactivation microbienne des aliments
Le présent travail porte sur l’application d’un système innovant d’inactivation microbienne, au moyen de champs électriques pulsés (PEF).
L’utilisation des PEF, documentée par les analyses d’expériences antérieures et par la littérature du secteur, suggère que la technique est efficace pour décomposer la population bactérienne des aliments liquides.
Résultats
Nous avons commencé par analyser l’eau non traitée. Dans la figure 1, nous pouvons voir comment et dans l’échantillon d’eau non traitée à la température de l’aqueduc (ligne noire), il y a un pic d’identification de Calcite (pour comparaison avec la ligne rouge, référence Calcite pure) qui identifie cette forme cristalline comme la plus répandue.
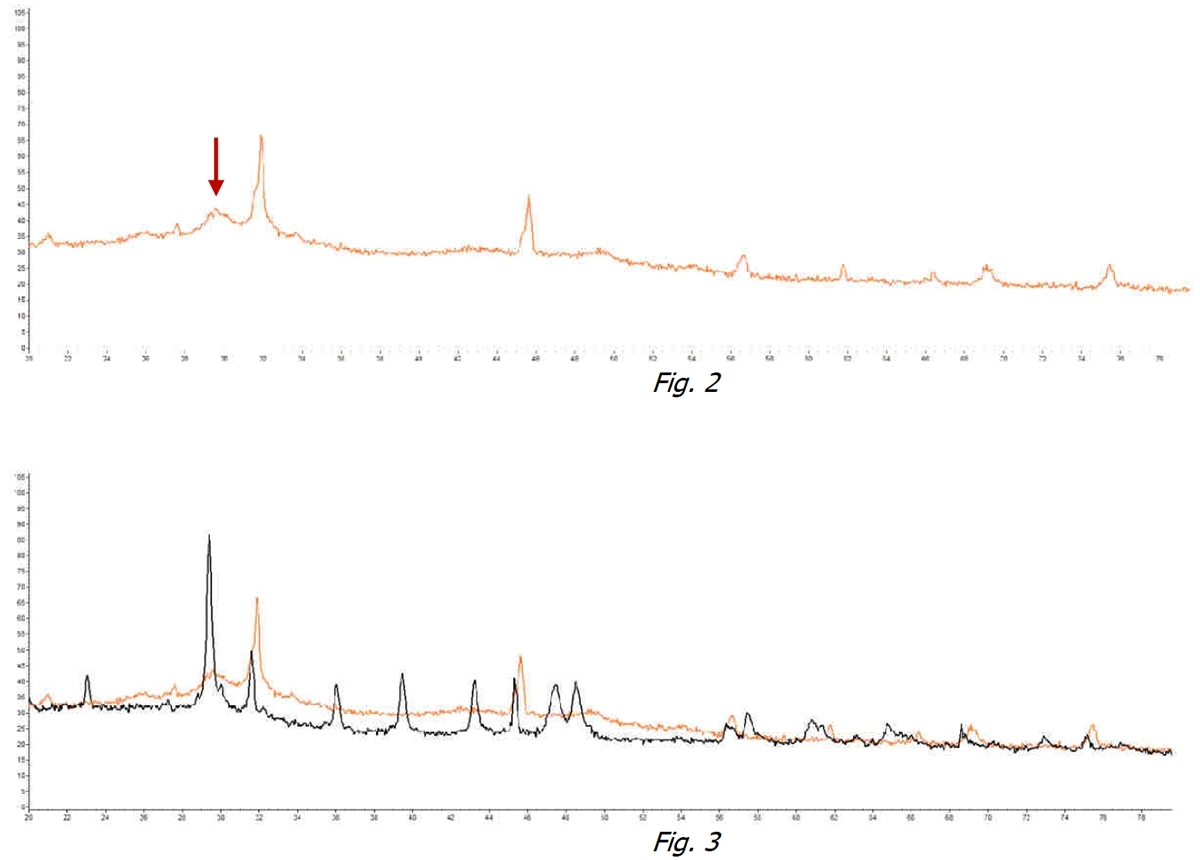
Sur la figure 2, on peut voir que dans la même eau soumise au traitement avec le dispositif ExtraH2O le pic identifiant de Calcite disparaît au profit d’une « bosse » sans pic spécifique. En général tous les pics d’identification d’une cristallisation disparaissent. Cela témoigne que les cristaux de Calcite ne se sont pas formés mais au contraire il existe une forme amorphe hydratée non cristallisée.
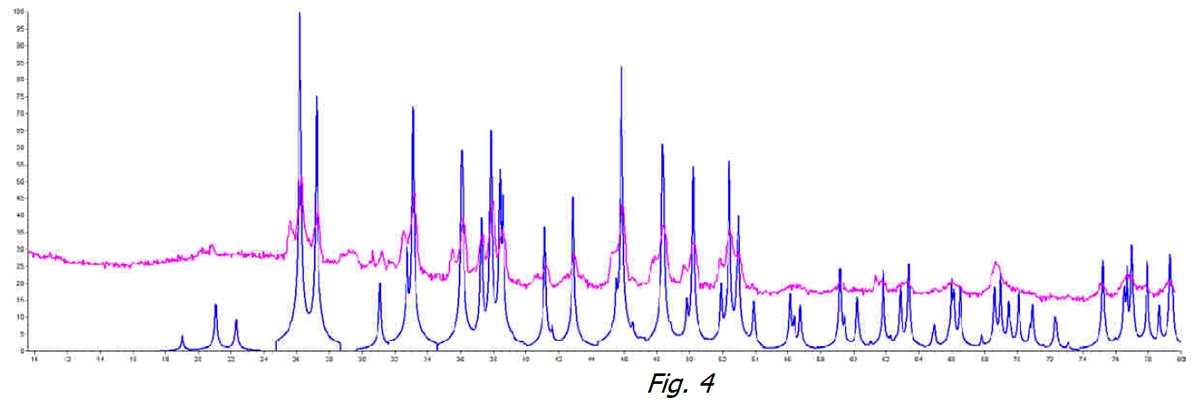
Si l’on compare ensuite les deux échantillons d’eau traitée (ligne orange) et non traitée (ligne noire) de la figure 3, le phénomène de non-cristallisation est bien visible. CaCO3 n’a aucun moyen de s’agréger dans l’une de ses formes cristallines stables.
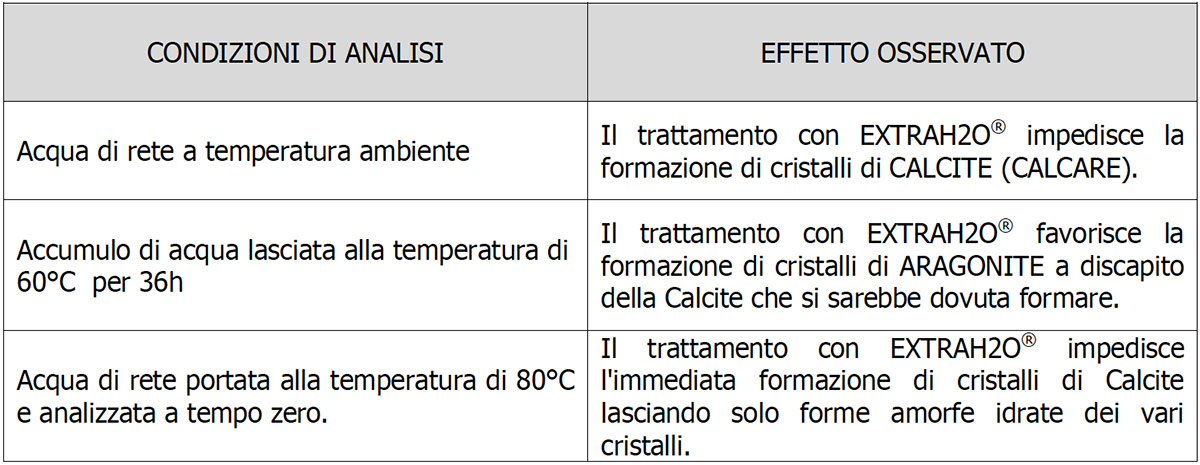
L’échantillon d’eau traitée avec ExtraH2O laissé pendant 36 h à une température de 60°C (Fig.4) montre la présence nette d’Aragonite sous forme cristalline. Le spectre de l’échantillon (raie fuchsia) est parfaitement superposable à celui de l’Aragonite pure (raie bleue). Comme cela est également rapporté dans la littérature à 60°C, la phase la plus stable de CaCO3 est l’Aragonite en l’absence totale de Calcite cristalline.
Sur la figure 5, nous pouvons comparer l’échantillon non traité à température ambiante (ligne noire) et celui traité porté à 80°C (ligne violette). D’après le graphique, il est évident que tous les pics se sont réduits, ce qui témoigne du fait que des cristaux de calcite stables ne peuvent pas se former.